Empat variabel yang menggambarkan keadaan gas:
o Tekanan (P)
o Volume (V)
o Temperatur (T)
o Jumlah mol gas, mol (n)
Hukum-hukum Gas antara lain hukum Boyle, Charles dan Gay-Lussac, Amonton, Avogadro, Dalton, Gas ideal, Kinetika, Gas Nyata.
1. Hukum Boyle
Robert Boyle pada tahun 1622 melakukan percobaan dengan menggunakan udara. Ia menyatakan bahwa volume sejumlah tertentu gas pada suhu yang konstan berbanding terbalik dengan tekanan yang dialami gas tersebut (Gambar .1).
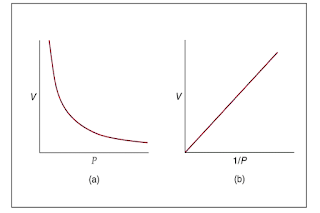 |
| Gambar 1. Hukum Boyle |
Hubungan tersebut dikenal sebagai Hukum Boyle, secara matematis
dapat dinyatakan sebagai berikut :
$V≈\frac{1}{P}$
(atau PV = konstan)
V = volume
P = tekanan
Lambang "≈" dibaca setara.
Persamaan hukum Boyle
P₁ V₁ = P₂ V₂
Persamaan-persamaan diatas berlaku untuk gas-gas yang bersifat ideal.
Contoh :
Silinder panjang pada pompa sepeda mempunyai volume 1131 cm3 dan
diisi dengan udara pada tekanan 1,02 atm. Katup keluar ditutup dan tangkai pompa didorong sampai volume udara 517 cm3. Hitunglah tekanan di dalam pompa itu.
Penyelesaian :
Perhatikan bahwa suhu dan jumlah gas tidak dinyatakan pada soal ini, jadi nilainya 22,414 L atm tidak dapat digunakan untuk tetapan C. bagaimanapun, yang diperlukan adalah pengandaian bahwa suhu tidak berubah sewaktu tangkai pompa didorong. Jika P₁ dan P₂ merupakan tekanan awal dan akhir, dan V₁ dan V₂ adalah volume awal dan akhir, maka berlaku:
P₁ V₁ = P₂ V₂
Sebab suhu dan jumlah udara dalam pompa tidak berubah. Substitusi
menghasilkan :
(1,02atm)(1131cm3)=P₂(517cm3)
Sehingga P₂ dapat diselesaikan:
P₂ = (1,02×1131)/517 =2,23 atm
2. Hukum Charles
Pada tekanan konstan, volume sejumlah tertentu gas sebanding
dengan suhu absolutnya (Gambar 5.13). Hukum di atas dapat
dituliskan sebagai berikut:
V ≈ T
$\frac{V}{T} = konstan$
V= volume gas
T= temperatur atau suhu gas
Persamaan hukum Charles
$\frac{V_1}{T_1} =\frac{V₂}{T₂}$
Hubungan di atas ditemukan oleh Charles pada tahun 1787 dan dikenal sebagai Hukum Charles. Secara grafik, hukum Charles dapat digambarkan seperti pada gambar di bawah. Terlihat
bahwa apabila garis-garis grafik diekstrapolasikan hingga memotong
sumbu X (suhu), maka garis-garis grafik tersebut akan memotong di satu titik yang sama yaitu – 273,15 °C. Titik ini dikenal sebagai suhu nol absolute yang nantinya dijadikan sebagai skala Kelvin. Hubungan antara Celcius dengan skala Kelvin adalah:
K = °C + 273,15
K = suhu absolut
°C = suhu dalam derajat Celcius
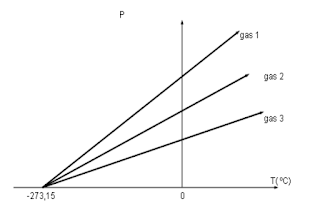 |
| Gambar 2. hukum Charles |
Sama hal-nya dengan hukum Boyle, hukum Charles juga berlaku untuk
gas ideal.
Contoh :
Seorang ilmuan yang mempelajari sifat hidrogen pada suhu rendah mengambil volume 2,50 liter hidrogen pada tekanan atmosfer dan suhu 25,00 °C dan mendinginkan gas itu pada tekanan tetap sampai – 200,00 °C. Perkirakan besar volume hidrogen!
Penyelesaian :
Langkah pertama konversikan suhu Celcius ke Kelvin selanjutnya gunakan hukum Charles
3. Hukum Avogadro
Pada tahun 1811, Avogadro mengemukakan hukum yang penting mengenai sifat-sifat gas. Dia menemukan bahwa pada suhu yang sama, sejumlah volume yang sama dari berbagai gas akan mempunyai jumlah partikel yang sama pula banyaknya (Gambar ).
Hukum Avogadro dapat dinyatakan sebagai berikut:
V ≈ n
(V/n = konstan)
n = jumlah mol gas
Satu mol didefinisikan sebagai massa dari suatu senyawa/zat yang mengandung atom atau molekul sebanyak atom yang terdapat pada dua belas gram karbon (¹²C). Satu mol dari suatu zat mengandung 6,023 x 10²³ molekul. Bilangan ini dikenal sebagai
Bilangan Avogadro. Berikut gambaran hukum Avogadro
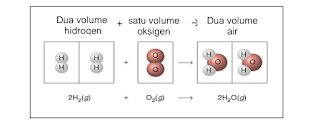 |
| Gambar 3. Hukum Avogadro |
4. Hukum Keadaan Standar
Untuk melakukan pengukuran terhadap volume gas, diperlukan suatu keadaan standar untuk digunakan sebagai titik acuan. Keadaan ini yang juga dikenal sebagai STP (Standart Temperature and Pressure) yaitu keadaan dimana gas mempunyai tekanan sebesar 1 atm (760 mmHg) dan suhu 0°C (273,15 K).
Satu mol gas ideal, yaitu gas yang memenuhi ketentuan semua
hukum-hukum gas akan mempunyai volume sebanyak 22,414 liter
pada keadaan standar ini (Gambar 4).
5. Hukum Gas Ideal
Definisi mikroskopik gas ideal, antara lain:
a. Suatu gas yang terdiri dari partikel-partikel yang dinamakan
molekul.
b. Molekul-molekul bergerak secara serampangan dan memenuhi
hukum-hukum gerak Newton.
c. Jumlah seluruh molekul adalah besar
d. Volume molekul adalah pecahan kecil yang diabaikan dari volume
yang ditempati oleh gas tersebut.
e. Tidak ada gaya yang cukup besar yang beraksi pada molekul
tersebut kecuali selama tumbukan.
f. Tumbukannya elastik (sempurna) dan terjadi dalam waktu yang
sangat singkat.
 |
| Gambar 4. gas ideal |
Apabila jumlah gas dinyatakan dalam mol (n), maka suatu bentuk persamaan umum mengenai sifat-sifat gas dapat diformasikan.
Sebenarnya hukum Avogadro menyatakan bahwa 1 mol gas ideal
mempunyai volume yang sama apabila suhu dan tekanannya sama.
Dengan menggabungkan persamaan Boyle, Charles dan persamaan Avogadro akan didapat sebuah persamaan umum yang dikenal sebagai persamaan gas ideal.
$PV = nRT$
Dengan $R = 8,314 J K^{-1} mol^{-1}$.
R adalah konstanta kesebandingan dan mempunyai suatu nilai tunggal yang berlaku untuk semua gas yang bersifat ideal. Persamaan di atas akan sangat berguna dalam perhitungan-perhitungan volume gas.
Persamaan gas ideal untuk kondisi awal dan akhir yang diketahui adalah
$\frac{P_1V_1}{T_1}=\frac{P_2V_2}{T_2}$
Dengan indeks 1 menyatakan keadaan awal dan indeks 2 menyatakan keadaan akhir.
Contoh :
Balon cuaca yang diisi dengan helium mempunyai volume 1,0 x 104 L pada 1,00 atm dan 30 °C. Balon ini sampai ketinggian yang tekanannya turun menjadi 0,6 atm dan suhunya –20°C. Berapa volume balon sekarang? Andaikan balon melentur sedemikian sehingga tekanan di dalam tetap mendekati tekanan di luar.
Penyelesaian:
Karena jumlah helium tidak berubah, kita dapat menentukan n1 sama
dengan n2 dan menggunakan persamaan gas ideal menjadi:
$\frac{P_1V_1}{T_1}=\frac{P_2V_2}{T_2}$
$V_2 = \frac{P_1V_1 T_2}{T_1 P_2}$
$V_2 = \frac{1,0×104 L ×2,00 atm ×253 K}{0,6 atm × 303 K}$
$V_2 = 14000 L$


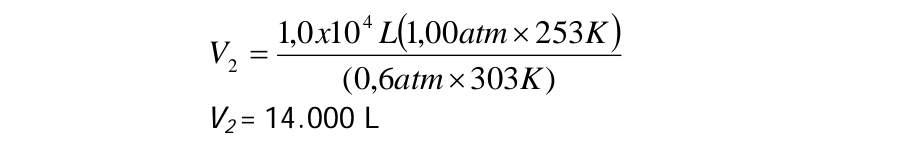









Tidak ada komentar:
Posting Komentar